ธาตุและสารประกอบ
ประเภทของธาตุในตารางธาตุ
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง ( ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง ( ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ ( Non metal ) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O 2) คลอรีน (Cl 2) ฟลูออรีน (F 2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) เป็นธาตุกึ่งตัวนำ คือ มันจะสามารถนำไฟฟ้าได้เฉพาะในภาวะหนึ่งเท่านั้น ธาตุกึ่งโลหะเหล่านี้จะอยู่บริเวณเส้นขั้นบันได ได้แก่ โบรอน (B) ซิลิคอน ( Si) เป็นต้น
ธาตุกัมมันตรังสี เป็นธาตุที่มีส่วนประกอบของ นิวตรอน กับโปรตอน ไม่เหมาะสม (>1.5) ธาตุที่ 83ขึ้นไปเป็นธาตุกัมมันตภาพรังสีทุกไอโซโทปมีครึ่งชีวิต
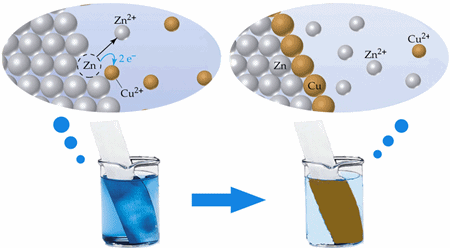
พันธะเคมี (Chemical Bond) หมายถึง แรงยึดเหนี่ยวระหว่างอะตอม 2 อะตอม หรือไอออนเข้าไว้ด้วยกันเป็นโมเลกุลหรือเป็นกลุ่มของอะตอม ทั้งนี้ แรงยึดเหนี่ยวจะขึ้นอยู่กับอิเล็กตรอนวงนอกของอะตอม (Valence Electron) เท่านั้น มีการถ่ายโอนหรือการใช้อิเล็กตรอนร่วมกันทำให้เกิดพันธะเคมีที่มีการจัดเรียงอิเล็กตรอนให้เกิดอิเล็กตรอนคู่ร่วมพันธะขึ้นมา ทำให้โมเลกุลที่เกิดขึ้นมีความเสถียรขึ้น
โดยทั่วไปอะตอมของธาตุเมื่ออยู่ลำพังจะพยายามจัดตัวเอง อาจมีการรวมกับอะตอมของ ธาตุชนิดเดียวกัน หรือรวมกับอะตอมของธาตุต่างชนิดกัน เพื่อให้มีอิเล็กตรอนวงนอกสุดให้เหมือน กับแก๊สเฉื่อย ซึ่งมีการจัดเรียงตัวของอิเล็กตรอนในลักษณะที่มีความเสถียร กล่าวคือ จำนวนวาเลนซ์อิเล็กตรอนของอะตอมเท่ากับ 8 (ยกเว้น He ที่มีจำนวนวาเลนซ์อิเล็กตรอนเท่ากับ2ที่มีความเสถียรแล้ว) ซึ่งอะตอมอาจทำได้ดังนี้
1. ให้อิเล็กตรอนแก่อะตอมอื่น
2. รับอิเล็กตรอนจากอะตอมอื่น
3. ใช้อิเล็กตรอนร่วมกับอะตอมอื่น... อ่านเพิ่มเติม
2. รับอิเล็กตรอนจากอะตอมอื่น
3. ใช้อิเล็กตรอนร่วมกับอะตอมอื่น... อ่านเพิ่มเติม